Для реакции энтропия системы: ответ на тест 1144552 - Химия
Для реакции 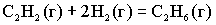 энтропия системы …
энтропия системы …
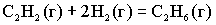 энтропия системы …
энтропия системы …
Вопрос задал(а): Анонимный пользователь, 13 Ноябрь 2020 в 20:56
На вопрос ответил(а): Анастасия Степанова, 13 Ноябрь 2020 в 20:56
На вопрос ответил(а): Анастасия Степанова, 13 Ноябрь 2020 в 20:56
